科濟葯業(股票代碼:2171.HK),一家主要專註於治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法公司,今日公告,在2021年第63屆美國血液學會(ASH)年會上, 公司自主研發的CT053(一種靶向BCMA的自體CAR-T細胞治療候選產品)的研究成果以兩篇海報形式進行了展示,其包含了:(1)一項在中國開展的Ⅰ/Ⅱ期研究(LUMMICAR-1)的持續有效性和安全性結果,和(2)在複發/難治多發性骨髓瘤(R/R MM)受試者中的高危因素匯總分析。
海報 #2821:LUMMICAR-1研究的持續有效性和安全性結果:一項在複發/難治多發性骨髓瘤中國患者中開展的全人源靶向BCMA CAR-T細胞(CT053)的Ⅰ/Ⅱ期研究
彙報人:北京朝陽醫院 陳文明教授
BCMA是靶向多發性骨髓瘤(MM)的一種前景光明的治療方法。CT053是一個自體的CAR-T細胞候選產品,包含了全人源BCMA特異性單鏈可變片段,具有高結合親和力和高單體比例。
LUMMICAR-1研究是一項在中國開展的多中心的、開放標籤的Ⅰ/Ⅱ期臨床試驗。這個試驗的主要研究終點是評估CT053的安全性和耐受性並確定Ⅱ期推薦劑量。次要研究終點是進一步評估有效性、安全性和葯代動力學。有效性評估參照國際骨髓瘤工作組(IMWG)2016標準。
截至2021年7月8日,14位既往經多種治療的R/R MM患者接受了CT053輸注。3名患者接受了1.0×108 CAR-T細胞;11名患者接受了1.5×108 CAR-T細胞。所有的患者都接受過至少三種前線治療方案,前線治療方案的中位數為6。其中,50%(7/14)的患者具有高危細胞遺傳學異常,14.3%(2/14)的患者伴有髓外病變(EMD),以及14.3%(2/14)的患者伴有國際分期系統(ISS)III期。
安全性
CT053總體耐受性良好,無≥3級細胞因子釋放綜合征(CRS)和神經毒性發生,無劑量限制性毒性(DLT)和治療相關死亡事件發生。未檢測到藥物免疫原性。
有效性
截至2021年7月8日,中位隨訪期為13.6個月(範圍4.2-22.4個月)。總緩解率(ORR)為100%(14/14)。其中78.6%(11/14)的患者達到嚴格意義的完全緩解(sCR)且全部為微小殘留病變(MRD)10-5陰性,並且有9例患者持續完全緩解及以上(CR/sCR)超過12個月,92.9%(13/14)的患者達到非常好的部分緩解(VGPR)及以上。12個月的無進展生存率為85.7%(12/14)。中位緩解持續時間(mDOR)和中位無進展生存期(mPFS)還沒有達到。在不伴有EMD的患者中觀察到了更佳的治療趨勢,CR/sCR率為91.7%(11/12),12個月PFS率達到100%。
結論
結果表明,CT053在R/R MM患者(50%的患者具有高危細胞遺傳學異常)中提供了深度且持久的療效反應,且總體耐受性良好。
海報 #1751:靶向BCMA CAR-T細胞(CT053)在複發/難治多發性骨髓瘤受試者中的高危因素匯總分析
彙報人:蘇州大學附屬第一醫院 傅琤琤教授
前期關於CT053的多項研究,包括3個研究者發起試驗(IIT)和LUMMICAR-1研究,顯示在既往經過多種治療的R/R MM患者中顯示出深度且持久的反應(在2020年的ASH年會中彙報)。我們匯總分析了這幾項研究基於高危因素(包括髓外病變[EMD]、高危細胞遺傳學異常和ISS III期)分層的綜合療效和安全性數據。
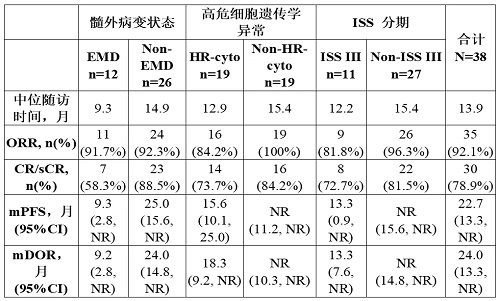
IIT研究和LUMMICAR-1研究的數據截止分別為2021年6月30日和2021年7月8日,共有38例患者接受CT053的輸注,其中,1例接受0.5×108,4例接受1.0×108,32例接受1.5×108和1例接受1.8×108 CAR-T細胞。所有患者既往接受過至少2種抗多發性骨髓瘤的治療方案,既往中位值方案數為6(範圍2-12)。其中,伴有EMD、高危細胞遺傳學異常和ISS III期的患者分別為31.6%、50.0%和28.9%。
有效性
在中位隨訪13.9個月中,ORR為92.1%(35/38),其中78.9%(30/38)的患者達到CR/sCR,86.8%(33/38)的患者達到VGPR及以上。mPFS和mDOR分別為22.7個月和24.0個月。
高危因素分層分析的結果看,伴有EMD的患者的CR/sCR率、mPFS和mDOR分別為58.3%、9.3個月和9.2個月,而無EMD的患者分別為88.5%、25.0個月和24.0個月。具有高危細胞遺傳學異常的患者的mPFS和mDOR分別為15.6個月和18.3個月,ISS III期患者的mPFS和mDOR均為13.3個月,而沒有高危細胞遺傳學異常和非ISS III期患者的mPFS和mDOR均未達到。結果表明基線時伴有EMD、高危細胞遺傳學異常或ISS III期的患者可能是影響臨床獲益的高危因素。詳情見下表:
安全性
無DLT或者治療相關死亡事件發生。1級或2級的CRS發生率為73.7%,且沒有≥3級的CRS發生。僅1例(2.6%, 1/38)患者發生3級神經毒性(癲癇),且經甲潑尼龍治療後完全恢復,該患者ISS III期,合併EMD。
結論
CT053在R/R MM患者中(包括高危人群)是一種具有前景的治療手段,且總體耐受性良好。北京朝陽醫院血液科主任醫師陳文明教授在報告中表示:“LUMMICAR-1研究結果證實全人源靶向BCMA CAR-T細胞產品CT053在複發/難治多發性骨髓瘤患者中提供了深度且持久的療效反應,且總體耐受性良好。”
蘇州大學附屬第一醫院血液內科主任醫師傅琤琤教授在報告中表示:“基線伴有EMD、高危細胞遺傳學異常或ISS III期等為影響複發/難治多發性骨髓瘤患者臨床療效的高危因素,但CT053在這些合併高危因素患者中仍然顯示出很好的臨床獲益。”
科濟葯業創始人、董事會主席、首席執行官、首席科學官李宗海博士表示:“感謝陳文明教授和傅琤琤教授代表研究者團隊在ASH年會上與業界分享CT053的研究數據,感謝所有研究者為本項目的傾力付出。希望CT053能重塑多發性骨髓瘤的治療方式,並成為多發性骨髓瘤患者的基礎性治療方法,早日惠及患者。”